Covid-19 : le SARS-CoV-2 peut persister dans le corps pendant des mois et se disséminer précocement dans le cerveau
geralt © Pixabay
Une étude américaine, reposant sur des autopsies de patients décédés de la Covid-19, a consisté à traquer la présence du coronavirus dans de très nombreux organes et tissus du corps humain. Les résultats montrent que le SARS-CoV-2 peut provoquer une infection disséminée et persister dans l’organisme pendant des mois. Le virus peut notamment largement diffuser dans le cerveau à un stade précoce.
Ces travaux ont été publiés le 20 décembre 2021 sur la plateforme de prépublication Research Square du groupe Nature. Il s’agit à ce jour de l’étude autopsique la plus complète dans la mesure où elle fournit des données concernant les différentes catégories de cellules infectées par le SARS-CoV-2 (fonction du tropisme cellulaire du virus), la quantité du virus (quantification de la charge virale) et la persistance dans le corps, notamment dans le cerveau.
Daniel Chertow et ses collègues des Instituts américains de la santé (NIH, Bethesda, Maryland) ont réalisé l’autopsie de 44 individus décédés de la Covid-19 dans les 230 jours (plus de sept mois) suivant le début des symptômes. Ces patients sont morts durant la première année de la pandémie.
Les autopsies ont été réalisées entre fin avril 2020 et début mars 2021. L’âge moyen des patients décédés était de 59 ans. Les auteurs précisent que plus de 95 % d’entre eux présentaient une comorbidité, le plus souvent de l’hypertension artérielle, de l’obésité, une maladie respiratoire chronique. L’intervalle moyen entre le début des symptômes et le décès était de 35 jours.
Plusieurs techniques ont été utilisées pour détecter la présence du SARS-CoV-2 : amplification du génome viral par PCR, l’hybridation in situ (méthode permettant de localiser le matériel génétique du virus au sein des cellules d’un tissu), l’immunohistochimie (qui détecte des protéines du virus dans les cellules d’un tissu). Les chercheurs ont également utilisé la technique PCR pour détecter des ARN sous-génomiques (ARNsg). La détection de ces formes d’ARN messager, issues de la transcription d’une fraction de l’ARN du génome viral, témoigne de la réplication du virus dans les cellules.
Dans certains cas, les biologistes moléculaires ont confirmé la présence dans certains sites extra-pulmonaires de virus SARS-CoV-2 capables de se répliquer en réussissant à l’isoler dans des cultures cellulaires.
Enfin, chez six individus, les biologistes ont étudié la diversité génétique des virions SARS-CoV-2 en utilisant l’amplification du génome viral et le séquençage génomique. Les cas autopsiques ont été classés en précoces, moyens ou tardifs, selon que le décès est intervenu après le début des symptômes dans un délai inférieur à 14 jours, entre 15 et 30 jours plus tard ou après le 31e jour.
Le virus SARS-CoV-2 a été détecté dans chacun des 44 cas autopsiques analysés et dans 75 localisations anatomiques sur les 85 étudiées. La charge virale la plus élevée a été détectée dans l’appareil respiratoire des cas précoces, tout en étant à un haut niveau dans chacun des tissus analysés chez de nombreux patients décédés précocement. Globalement, la charge virale était moins importante chez les patients du groupe moyen et plus encore de ceux du groupe tardif. Même dans ce dernier groupe, une persistance à bas niveau de l’ARN viral a été détectée dans de nombreux tissus chez tous les patients, et ce bien que le virus soit demeuré indétectable dans le plasma.
Persistance de l’ARN viral de longue durée
Les chercheurs soulignent que l’ARN du SARS-CoV-2 a été détecté dans le cerveau des six individus décédés tardivement. Chez cinq d’entre eux, le virus était présent dans la plupart des régions cérébrales analysées, notamment chez un patient décédé 230 jours après le début des symptômes.
Chez 43 des 44 cas autopsiques, l’ARN viral a été détecté dans le tissu respiratoire. Il a été trouvé dans le tissu cardiovasculaire dans 35 cas sur 44, dans le tissu lymphoïde dans 38 cas, dans le tissu de l’appareil reproducteur dans 17 cas, dans le muscle, la peau et le tissu nerveux périphérique dans 30 cas, dans le tissu oculaire et d’humeurs dans 22 cas et dans le tissu cérébral dans 10 des 11 cas analysés.
Les chercheurs rapportent avoir par ailleurs détecté les ARN sous-génériques (ARNsg), indicateurs d’une réplication virale, dans tous les tissus analysés, en particulier parmi le patients décédés précocement (14 cas sur 17, soit dans plus de 82 % des cas). Parmi les patients des groupes moyen et tardif, la présence d’ARN sous-génomiques a été respectivement détectée chez environ 61 % et 42 % des cas.
Le virus a été isolé dans les cultures cellulaires de nombreux sites pulmonaires et extra-pulmonaires, parmi lesquels le poumon, les bronches, les fosses nasales (cornets nasaux), le cœur, les ganglions lymphatiques intra-thoraciques, l’intestin grêle et les glandes surrénales chez les cas décédés dans les sept premiers jours après le début des symptômes.
Compartimentalisation génétique entre les sites pulmonaires et extra-pulmonaires
Les biologistes moléculaires ont analysé les séquences génomiques codant la protéine spike présentes dans 46 tissus provenant de 6 individus. Il ressort que les populations virales ayant disséminé chez ces patients étaient relativement homogènes, sans changement dans les codons de la protéine spike. Cela dit, les chercheurs ont remarqué chez certains patients du groupe précoce une diversité intra-individuelle.
Ainsi, chez un individu, des différences génétiques notables ont été observées dans les virus résidant dans les poumons et ceux présents dans le cerveau. Une mutation (D80F) a été détectée dans 31 échantillons pulmonaires analysés mais dans aucune des séquences virales détectées au niveau du cerveau. Parmi celles-ci, certaines étaient en revanche porteuses d’une mutation (G1219V), absente dans d’autres tissus. Chez un autre individu, alors que 4 525 séquences de la protéine spike analysées étaient identiques, une mutation a été préférentiellement détectée dans des sites extra-pulmonaires, notamment dans les ventricules cardiaques et les ganglions lymphatiques intra-thoraciques.
Ces résultats suggèrent qu’il existe chez certains individus une « compartimentalisation génétique » entre les sites pulmonaires et non pulmonaires (dont le cerveau), autrement dit une réplication indépendante du virus dans ces sites. De rares études antérieures avaient déjà rapporté une diversité intra-individuelle de bas niveau.
Persistance du SARS-CoV-2 dans de multiples sites anatomiques
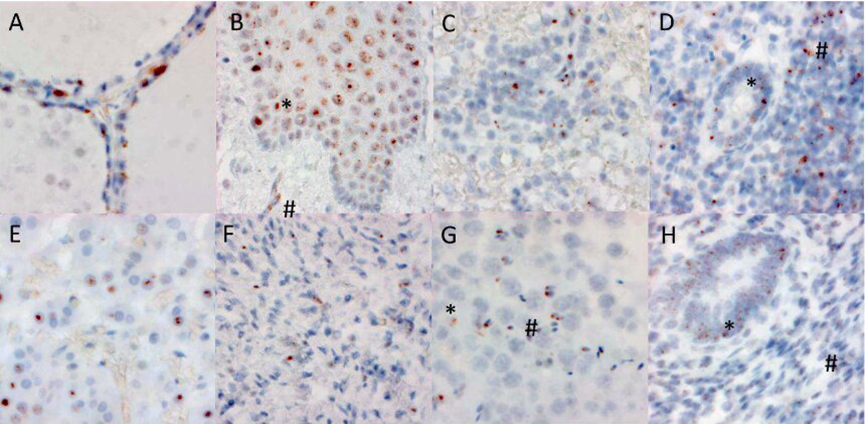
Détection de l’ARN du SARS-CoV-2 par hybridation in situ dans de nombreux sites extra-pulmonaires. A : Thyroïde : cellules folliculaires. B : Œsophage: épithélium stratifié et capillaires du stroma. C : Rate. D : Appendice. E : Surrénale : cellules sécrétrices endocrines. F : Ovaire : cellules stromales. G : Testicule : cellules de Sertoli et cellules germinales matures dans les tubes séminifères. H : Endomètre : épithélium glandulaire et cellules stromales. Chertow D, et al. ResearchSquare [Preprint]. 20 Dec, 2021.
Les chercheurs ont utilisé l’hybridation in situ (technique permettant de détecter une séquence génétique sur une coupe histologique de tissu), sur six types cellulaires provenant de l’ensemble des organes prélevés lors des autopsies. Les résultats indiquent que, selon les cas, l’ARN codant la protéine spike a été détecté dans le cœur (cellules musculaires, endothélium, muscles lisses des vaisseaux), dans le péricarde (enveloppe entourant le cœur). De même, un signal positif a été détecté dans l’aorte (cellules de l’intima, en contact direct avec le sang). Cet ARN viral était également présent à l’intérieur de globules blancs (leucocytes mononucléés) présents dans la rate, l’appendice et l’épithélium du côlon. La détection de l’ARN de la protéine spike représente soit le témoin d’une infection virale, soit la présence du virus phagocyté dans les macrophages présents dans ces organes.
De nombreuses cellules d’autres organes contenaient l’ARN de la protéine spike, tels que l’épithélium de l’œsophage, des cellules du foie (dont les cellules de Kupffer, les hépatocytes et l’épithélium des canaux biliaires), des amas lymphoïdes du côlon. Il en était de même dans le rein (cellules des tubules rénaux et vaisseaux des glomérules où a lieu la formation de l’urine primitive, élaborée à partir du sang filtré).
Les cellules endocrines de la thyroïde et glandulaires du pancréas renfermaient également cet ARN viral, de même que des cellules de l’appareil reproducteur (cellules de Leydig et de Sertoli dans les testicules, cellules germinales dans les tubes séminifères, épithélium glandulaire de l’endomètre, cellules musculaires du muscle utérin). Idem pour les myocytes, cellules du muscle squelettique. Sans oublier l’endothélium vasculaire, qui tapisse l’intérieur de l’ensemble des vaisseaux de l’organisme.
Détection dans le cerveau de l’ARN codant la protéine spike
Au niveau cérébral, l’ARN de la protéine spike a été détecté dans les neurones, les cellules gliales (cellules de soutien) et l’endothélium des vaisseaux cérébraux dans tous les lobes cérébraux des patients des groupes précoce, moyen et tardif. Cet ARN a également été trouvé dans le cervelet (neurones, cellules de Purkinje, endothélium vasculaire).
Sur le plan histologique, les anatomopathologistes ont notamment observé une atteinte alvéolaire diffuse au niveau pulmonaire et au niveau cardiaque des infiltrats inflammatoires dans le myocarde. De minuscules caillots sanguins (micro-thrombi) ont également été décrits, de même qu’un appauvrissement du nombre de lymphocytes (lymphodépletion) dans les ganglions lymphatiques et dans la rate. Peu de changements morphologiques notables ont été observés à l’examen histologique du cerveau des 11 cas étudiés.
Les chercheurs insistent sur la rareté d’une inflammation significative en dehors de l’appareil pulmonaire, même chez les patients décédés à un stade tardif de l’infection, plusieurs mois après le début des symptômes.
De précédentes études avaient rapporté la présence de l’ARN viral dans certains sites extra-pulmonaires. Cette étude est cependant plus informative dans la mesure où elle a permis de détecter et de quantifier les niveaux de charge virale, mais également d’isoler le virus dans des cultures cellulaires. En résumé, elle montre que « le coronavirus dissémine à un haut niveau dans le corps et dans le cerveau à un stade précoce de l’infection ». Et les auteurs de souligner que « la réplication virale se produit dans des sites extra-pulmonaires durant la première semaine suivant le début des symptômes ».
Cette étude confirme les résultats d’études antérieures qui avaient détecté la présence de l’ARN du SARS-CoV-2 dans le cœur, les ganglions lymphatiques, l’intestin grêle et les surrénales. Ces nouveaux résultats montrent donc que le SARS-CoV-2 est effectivement capable d’infecter et de se répliquer dans ces tissus, mais également d’autres sites extra-pulmonaires tels que le côlon, les tissus lymphoïde et oculaire. Et les chercheurs de souligner que bien que les patients au stade tardif présentent au niveau pulmonaire une moindre quantité de SARS-CoV-2 que les patients précoces, leurs taux de charge virale sont similaires dans les tissus pulmonaires et extra-pulmonaires.
Les chercheurs précisent avoir détecté des ARN sous-génomiques dans au moins un tissu dans plus de la moitié des cas (14 sur 27), au-delà de la deuxième semaine après le début des symptômes, ce qui suggère l’existence d’une réplication virale prolongée (jusqu’à 99 jours dans les sites extra-pulmonaires).
Dissémination du virus même chez les patients décédés d’une forme asymptomatique ou légère de Covid
Bien que cette cohorte soit principalement composée de formes sévères de Covid-19, elle comptait deux personnes décédées à un stade précoce de l’infection (par embolie pulmonaire à domicile et du fait de complications fatales liées à une comorbidité). Ces deux patients présentaient cependant déjà une infection disséminée, avec détection de l’ARN du SARS-CoV-2 dans l’ensemble du corps, dont le cerveau, et détection d’ARN sous-génomiques dans de nombreux sites.
Selon les auteurs, ces résultats suggèrent que l’importante dissémination du virus dans l’organisme est la conséquence d’une virémie précoce (présence du virus dans le sang) et que le virus parvient au cerveau en franchissant la barrière hémato-méningée. Selon eux, la réplication virale peut donc survenir à un stade précoce de Covid-19, même en cas d’infection asymptomatique ou de forme légère de la maladie.
On attribue généralement certains mécanismes sous-tendant la survenue de symptômes prolongés faisant suite à une infection par SARS-CoV-2 (baptisés Covid-longue ou Covid long) à une réaction inflammatoire généralisée ou locale. Or les auteurs de cette étude font remarquer que leurs résultats sont largement en faveur d’une persistance du virus et qu’ils n’ont pas observé d’inflammation significative en dehors de l’appareil pulmonaire, ceci même parmi les patients décédés plusieurs mois après le début des symptômes. Et de conclure que mieux comprendre la physiopathologie des symptômes prolongés faisant suite à une infection par SARS-CoV-2 pourrait déboucher sur une amélioration de la prise en charge des patients présentant des troubles séquellaires.
Marc Gozlan (Suivez-moi sur Twitter, Facebook, LinkedIn)
Pour en savoir plus :
Chertow D, Stein S, Ramelli S, et al. SARS-CoV-2 infection and persistence throughout the human body and brain. ResearchSquare [Preprint] Posted 20 Dec, 2021
D’Agnillo F, Walters KA, Xiao Y, et al. Lung epithelial and endothelial damage, loss of tissue repair, inhibition of fibrinolysis, and cellular senescence in fatal COVID-19. Sci Transl Med. 2021 Nov 17;13(620):eabj7790. doi: 10.1126/scitranslmed.abj7790
Yao XH, Luo T, Shi Y, He ZC, et al. A cohort autopsy study defines COVID-19 systemic pathogenesis. Cell Res. 2021 Aug;31(8):836-846. doi: 10.1038/s41422-021-00523-8
Lythgoe KA, Hall M, Ferretti L, et al. SARS-CoV-2 within-host diversity and transmission. Science. 2021 Apr 16;372(6539):eabg0821. doi: 10.1126/science.abg0821
Valesano AL, Rumfelt KE, Dimcheff DE, et al. Temporal dynamics of SARS-CoV-2 mutation accumulation within and across infected hosts. PLoS Pathog. 2021 Apr 7;17(4):e1009499. doi: 10.1371/journal.ppat.1009499
Bhatnagar J, Gary J, Reagan-Steiner S, et al. Evidence of Severe Acute Respiratory Syndrome Coronavirus 2 Replication and Tropism in the Lungs, Airways, and Vascular Endothelium of Patients With Fatal Coronavirus Disease 2019: An Autopsy Case Series. J Infect Dis. 2021 Mar 3;223(5):752-764. doi: 10.1093/infdis/jiab039
Gaebler C, Wang Z, Lorenzi JCC, et al. Evolution of antibody immunity to SARS-CoV-2. Nature. 2021 Mar;591(7851):639-644. doi: 10.1038/s41586-021-03207-w
Dorward DA, Russell CD, Um IH, et al. Tissue-Specific Immunopathology in Fatal COVID-19. Am J Respir Crit Care Med. 2021 Jan 15;203(2):192-201. doi: 10.1164/rccm.202008-3265OC
Puelles VG, Lütgehetmann M, Lindenmeyer MT, et al. Multiorgan and Renal Tropism of SARS-CoV-2. N Engl J Med. 2020 Aug 6;383(6):590-592. doi: 10.1056/NEJMc2011400
Matschke J, Lütgehetmann M, Hagel C, et al. Neuropathology of patients with COVID-19 in Germany: a post-mortem case series. Lancet Neurol. 2020 Nov;19(11):919-929. doi: 10.1016/S1474-4422(20)30308-2
Schurink B, Roos E, Radonic T, et al. Viral presence and immunopathology in patients with lethal COVID-19: a prospective autopsy cohort study. Lancet Microbe. 2020 Nov;1(7):e290-e299. doi: 10.1016/S2666-5247(20)30144-0
Tonkin-Hill G, Martincorena I, Amato R, et al; Wellcome Sanger Institute COVID-19 Surveillance Team. Patterns of within-host genetic diversity in SARS-CoV-2. Elife. 2021 Aug 13;10:e66857. doi: 10.7554/eLife.66857
Remmelink M, De Mendonça R, D’Haene N, et al. Unspecific post-mortem findings despite multiorgan viral spread in COVID-19 patients. Crit Care. 2020 Aug 12;24(1):495. doi: 10.118
https://www.lemonde.fr/blog/realitesbiomedicales/2021/12/24/covid-19-le-sars-cov-2-peut-persister-dans-le-corps-pendant-des-mois-et-disseminer-precocement-dans-le-cerveau/
Le Mond 24 DÉCEMBRE 2021 PAR MARC GOZLAN
SARS-CoV-2 可以在体内持续数月且早期可在大脑中传播
2021年12月20日Nature集团的Research Square预发表平台上发表一项关于Covid-19病故者的尸体解剖研究。该项研究由美国卫生研究院根据44名感染者的尸检报告得来。
尸检从2020年4月下旬持续至2021年3月上旬,死者的平均年龄为59岁,超95%的死者有合并症,如高血压、肥胖、慢性呼吸系统疾病等,且均于感染症状出现后230天内死亡,平均时间为35天。尸检病例分为早期(症状出现后不到14天死亡)、中期(症状出现15至30天内死亡)或晚期(症状出现第31天后死亡)病例。
研究发现:
- 每一例尸检病例中均检测到了SARS-CoV-2病毒,且在所研究的85个解剖位置中有75个检测到了SARS-CoV-2病毒病毒。
- 在早期病例的呼吸系统中检测到最高的病毒载量,且每个组织中的病毒载量都处于高水平;中期组患者的病毒载量较低;晚期组患者的病毒载量更低,但许多组织中也检测到低水平的病毒RNA持续存在。
- 在所有被分析的组织中都检测到了亚通用RNA(sgRNA),即病毒复制的指标:早期病例组中(17例中有14例,即超过82%的病例)。中晚期病例组,分别在约61%和42%的病例中检测到亚基因组RNA的存在。
- 观察分析可知存在于肺部和大脑的病毒存在显著的遗传差异。例如:在被分析的31个肺样本中检测到的突变(D80F),但在大脑中没有被检测到;在大脑中检测到一些其他组织中不存在的突变(G1219V)。这些结果表明,在某些个体中,肺和非肺部位(包括大脑)之间存在“遗传区室化”,换句话说,病毒在这些部位独立复制。
- 肺部系统以外的严重炎症较少见,即使是在感染晚期。冠状病毒于感染早期在体内和大脑中高水平传播,病毒于症状出现后第一周在肺外部位进行复制。SARS-CoV-2确实能够在心脏、淋巴结、小肠和肾上腺中感染和复制,但也能够在其他肺外部位(如结肠、淋巴和眼组织)中感染和复制。
- 病毒能够在无症状或轻症患者体内传播。研究结果表明病毒在体内的显着传播表现是早期病毒血症(血液中存在病毒),且病毒通过血脑膜屏障到达大脑。病毒复制因此可能发生在Covid-19的早期阶段,即使是对无症状或轻症患者而言。








